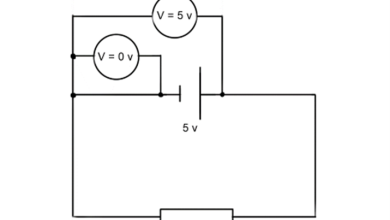
Le loi de la concentration molaire, souvent appelé loi de la concentration molale, est une notion fondamentale en chimie qui joue un rôle crucial dans la compréhension des solutions et de leurs propriétés. Cette loi permet de quantifier la concentration d’une solution en termes de quantité de soluté par rapport à la quantité de solvant. Pour bien saisir son importance, il est essentiel de comprendre d’abord quelques concepts clés liés à la concentration des solutions.
Définition et Formule
La concentration molaire, notée généralement C ou M, est définie comme la quantité de soluté dissous dans un volume donné de solution. La formule de base pour calculer la concentration molaire est :
C=Vn
où :
- C est la concentration molaire (en moles par litre, mol/L),
- n est la quantité de soluté en moles (mol),
- V est le volume de la solution en litres (L).
En d’autres termes, la concentration molaire est le rapport entre le nombre de moles de soluté et le volume total de la solution. Par exemple, une solution contenant 1 mole de sel dissous dans 1 litre d’eau aura une concentration molaire de 1 mol/L.
Importance et Applications
La concentration molaire est essentielle dans de nombreux domaines de la chimie et des sciences connexes. Voici quelques applications clés :
-
Préparation des Solutions : La concentration molaire est utilisée pour préparer des solutions de concentrations spécifiques. En laboratoire, les chimistes utilisent des solutions avec des concentrations précises pour mener à bien des expériences et des synthèses chimiques.
-
Calcul des Réactions : Dans les réactions chimiques, la concentration des réactifs et des produits est cruciale pour déterminer la vitesse de réaction et l’équilibre chimique. La loi de la concentration molaire permet de prédire comment une réaction évoluera en fonction des concentrations des substances impliquées.
-
Analyse des Solutions : Les méthodes analytiques, telles que la spectroscopie et la chromatographie, reposent sur la concentration molaire pour quantifier les constituants d’une solution. Par exemple, la loi de Beer-Lambert est une relation entre la concentration d’une solution et l’absorbance de la lumière, utilisée en spectroscopie pour mesurer la concentration de solutés.
-
Contrôle de la Qualité : Dans l’industrie pharmaceutique et chimique, la concentration molaire est utilisée pour garantir que les produits finis ont les concentrations correctes de leurs ingrédients actifs, assurant ainsi l’efficacité et la sécurité des produits.
Calculs et Exemples
Pour illustrer l’application de la loi de la concentration molaire, considérons quelques exemples pratiques :
-
Préparation d’une Solution : Supposons que vous souhaitez préparer 500 mL d’une solution de NaCl avec une concentration molaire de 0,2 mol/L. La quantité de NaCl nécessaire peut être calculée en utilisant la formule :
n=C×V
où C=0,2mol/L et V=0,5L. Ainsi :
n=0,2mol/L×0,5L=0,1mol
Donc, vous auriez besoin de 0,1 mole de NaCl pour préparer la solution souhaitée. En convertissant cette quantité en grammes (en utilisant la masse molaire du NaCl, qui est environ 58,44 g/mol), vous obtiendriez :
Masse=0,1mol×58,44g/mol=5,844g
Vous dissolvez donc 5,844 g de NaCl dans 500 mL d’eau pour obtenir la solution désirée.
-
Dilution d’une Solution : Si vous avez une solution concentrée de 2 mol/L de NaCl et que vous souhaitez obtenir une solution de 0,5 mol/L à partir de cette solution concentrée, vous pouvez utiliser la formule de dilution :
C1×V1=C2×V2
où :
- C1 est la concentration initiale (2 mol/L),
- V1 est le volume de la solution concentrée à utiliser,
- C2 est la concentration finale (0,5 mol/L),
- V2 est le volume final souhaité.
Si vous voulez préparer 1 L de la solution diluée, alors :
2mol/L×V1=0,5mol/L×1L
En résolvant pour V1 :
V1=2mol/L0,5mol/L×1L=0,25L
Vous devrez donc prélever 250 mL de la solution concentrée et la diluer avec de l’eau jusqu’à obtenir un volume final de 1 L.
Relations avec d’autres Concepts
La concentration molaire est liée à d’autres concepts importants en chimie, notamment :
-
Molarité et Molalité : La molarité (M) est la concentration en moles de soluté par litre de solution, tandis que la molalité (m) est la concentration en moles de soluté par kilogramme de solvant. Bien que les deux concepts mesurent la concentration, ils sont utilisés dans des contextes différents et ne sont pas directement interchangeables.
-
Concentration Massique : La concentration massique mesure la masse de soluté par unité de volume de solution (g/L). Pour convertir entre la concentration massique et molaire, on utilise la masse molaire du soluté.
-
Le Loi de Beer-Lambert : En spectroscopie, la loi de Beer-Lambert décrit comment l’absorbance de la lumière par une solution est proportionnelle à la concentration du soluté, ce qui permet de déterminer la concentration molaire en mesurant l’absorbance.
Conclusion
En résumé, la loi de la concentration molaire est un outil fondamental pour la chimie, permettant de quantifier et de manipuler les solutions de manière précise. Sa compréhension est cruciale pour les scientifiques et ingénieurs travaillant dans divers domaines, de la recherche fondamentale à l’industrie, en passant par la médecine et l’analyse environnementale. La capacité à préparer, diluer, et analyser des solutions en utilisant la concentration molaire est indispensable pour mener des expériences réussies et obtenir des résultats fiables.