Il semble que vous souhaitiez en savoir plus sur le nombre d’Avogadro, une constante fondamentale en chimie et en physique. Voici un article complet sur ce sujet :
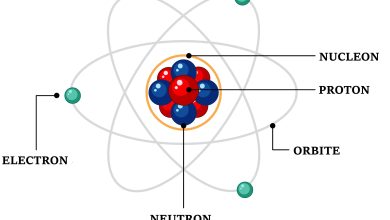
Le nombre d’Avogadro, noté souvent sous le symbole NA, est une constante physique centrale en chimie et en physique. Il représente le nombre d’entités élémentaires (atomes, molécules, ions, etc.) présentes dans une mole de substance. Sa valeur numérique exacte est définie comme étant égale à 6,02214076×1023 entités par mole. Ce nombre est fondamental car il permet de relier les échelles microscopiques et macroscopiques des systèmes chimiques.
Historique
Le concept de nombre d’Avogadro tire son nom du physicien italien Amedeo Avogadro (1776-1856), qui a contribué de manière significative à l’élaboration des principes fondamentaux de la théorie atomique. Bien que les idées d’Avogadro aient été initialement mal comprises et contestées, elles ont finalement été reconnues comme essentielles pour comprendre la nature des gaz et des molécules.
La notion clé introduite par Avogadro était que, à température et pression constantes, des volumes égaux de gaz contiennent un nombre égal de molécules. Cela a jeté les bases pour déterminer que des quantités égales de substances dans des conditions similaires de température et de pression contiennent le même nombre de particules, que ce soit des atomes, des molécules ou d’autres entités microscopiques.
Définition
Formellement, le nombre d’Avogadro est défini comme la quantité d’entités élémentaires contenues dans une mole, qui est une unité fondamentale du Système international (SI). Une mole de substance contient donc exactement 6,02214076×1023 entités élémentaires. Cette constante est utilisée pour établir des relations entre la masse d’une substance et le nombre de ses particules constitutives, facilitant ainsi le calcul des réactions chimiques et des propriétés physiques à l’échelle macroscopique.
Importance en Chimie
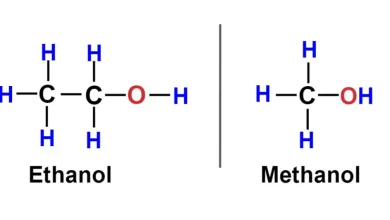
En chimie, le nombre d’Avogadro est essentiel pour convertir les unités de masse en nombre de particules et vice versa. Par exemple, la masse molaire d’une substance est la masse d’une mole de cette substance exprimée en grammes par mole. Cette grandeur permet aux chimistes de mesurer et de quantifier les quantités de substances impliquées dans des réactions chimiques, ce qui est crucial pour la synthèse de composés, la formulation de médicaments, et d’autres applications industrielles et scientifiques.
Applications
Le nombre d’Avogadro trouve des applications dans de nombreux domaines de la chimie et de la physique, y compris :
-
Calculs Stœchiométriques : Permet de calculer les quantités de réactifs nécessaires et les produits formés lors de réactions chimiques.
-
Détermination des Propriétés Physiques : Aide à comprendre et prédire les propriétés physiques des substances, telles que la densité, la conductivité électrique, et d’autres caractéristiques.
-
Conception de Matériaux : Utilisé dans la conception de nouveaux matériaux, en particulier dans le domaine des nanotechnologies où les propriétés des matériaux peuvent être modifiées en manipulant le nombre et la disposition des atomes.
Constante Fondamentale
En tant que constante fondamentale, le nombre d’Avogadro est aussi important que des constantes telles que la vitesse de la lumière dans le vide ou la constante de Planck. Sa valeur exacte a été déterminée avec une grande précision grâce aux progrès de la métrologie et des techniques expérimentales modernes, permettant ainsi des calculs précis et fiables en chimie et en physique.
En conclusion, le nombre d’Avogadro joue un rôle central dans notre compréhension de la matière à l’échelle atomique et moléculaire. Sa définition précise et son utilisation généralisée en font un pilier essentiel de la chimie moderne, facilitant la recherche, l’innovation technologique et le développement de nouvelles substances et matériaux.