Les Applications de l’Ingénierie Génétique dans le Domaine Médical
L’ingénierie génétique est un domaine interdisciplinaire qui a émergé au cours du 20e siècle et qui a révolutionné de nombreux secteurs, en particulier la médecine. Grâce à la compréhension des mécanismes moléculaires du génome, les scientifiques sont aujourd’hui capables de manipuler l’ADN à des fins thérapeutiques, diagnostiques et préventives. Les applications médicales de l’ingénierie génétique sont vastes et touchent à la fois la recherche fondamentale et les traitements cliniques. Cet article explore les principales applications de cette technologie dans le domaine médical, tout en mettant en évidence ses avantages, défis et perspectives d’avenir.
1. Thérapie génique : une révolution pour les maladies génétiques
La thérapie génique constitue l’une des applications les plus prometteuses de l’ingénierie génétique. Elle vise à corriger des anomalies génétiques à l’origine de diverses pathologies en introduisant, modifiant ou supprimant des gènes dans les cellules d’un individu. Ce type de traitement a le potentiel de guérir des maladies héréditaires qui étaient jusqu’à présent incurables.
1.1. Maladies traitées par la thérapie génique
De nombreuses maladies génétiques, telles que la mucoviscidose, l’hémophilie, la dystrophie musculaire de Duchenne, ou encore certaines formes de cancers, peuvent bénéficier d’un traitement par thérapie génique. Par exemple, dans le cas de la mucoviscidose, une mutation dans le gène CFTR perturbe la production d’une protéine responsable de la régulation du sel et de l’eau dans les cellules. L’introduction d’une copie fonctionnelle du gène CFTR dans les cellules du patient pourrait théoriquement restaurer cette fonction et améliorer la qualité de vie des malades.
1.2. Méthodes de thérapie génique
Les approches les plus courantes de la thérapie génique incluent l’insertion directe de gènes via des vecteurs viraux, l’édition génétique par CRISPR-Cas9, et la modification des cellules souches. La méthode CRISPR-Cas9, en particulier, a fait l’objet de recherches intensives en raison de sa précision et de son efficacité. Ce système d’édition génétique permet de « couper » l’ADN à des endroits spécifiques et de remplacer des séquences défectueuses par des séquences correctes, ouvrant ainsi la voie à des traitements plus ciblés.
2. Médecine personnalisée : adapter les traitements à chaque individu
L’ingénierie génétique est également au cœur de l’essor de la médecine personnalisée. Ce concept repose sur l’idée que chaque individu possède un profil génétique unique, et que les traitements médicaux devraient être adaptés à ce profil pour être plus efficaces. Les progrès réalisés dans le séquençage du génome humain ont permis de mieux comprendre les différences génétiques entre les individus, ouvrant ainsi la voie à des thérapies sur mesure.
2.1. Séquençage génétique et médecine personnalisée
Le séquençage du génome permet de déterminer les variations génétiques spécifiques qui influencent la réponse d’un patient à un médicament. Par exemple, certaines personnes métabolisent les médicaments plus rapidement que d’autres en raison de variations génétiques dans les enzymes responsables de leur dégradation. En tenant compte de ces variations, les médecins peuvent prescrire des traitements plus efficaces et éviter les effets secondaires.
Un exemple concret de la médecine personnalisée est l’utilisation de tests génétiques pour prédire la réponse aux traitements contre le cancer. Les mutations dans des gènes spécifiques, comme HER2 dans le cancer du sein ou EGFR dans le cancer du poumon, permettent aux oncologues de choisir des traitements ciblés, comme les thérapies biologiques, qui augmentent considérablement les chances de guérison.
3. Vaccins génétiques : une nouvelle approche contre les infections
Les vaccins génétiques représentent une innovation majeure rendue possible par les avancées en génétique et en biotechnologie. Contrairement aux vaccins traditionnels qui contiennent des agents pathogènes inactivés ou des protéines virales, les vaccins génétiques utilisent de l’ADN ou de l’ARN pour induire une réponse immunitaire.
3.1. Les vaccins à ARN : succès et perspectives
Les vaccins à ARN messager (ARNm), comme ceux développés contre le COVID-19 par les entreprises Pfizer-BioNTech et Moderna, sont un exemple emblématique de l’application de l’ingénierie génétique dans le domaine des vaccins. Ces vaccins utilisent une séquence d’ARNm codant pour une protéine spécifique du virus (comme la protéine Spike du SARS-CoV-2) qui, une fois introduite dans le corps humain, stimule le système immunitaire à produire des anticorps.
L’avantage des vaccins à ARNm réside dans leur rapidité de développement et leur flexibilité. Il est possible de concevoir un vaccin en quelques semaines en modifiant simplement la séquence d’ARNm en fonction du virus cible. De plus, ces vaccins ne nécessitent pas la culture du virus dans des laboratoires spécialisés, ce qui simplifie leur production.
3.2. Vaccins contre le cancer
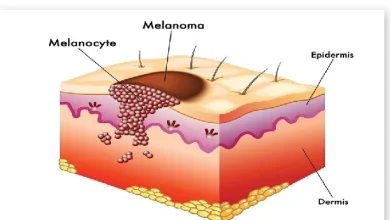
Les vaccins génétiques ne se limitent pas aux infections virales. Ils peuvent également être utilisés pour traiter certains types de cancer. Ces vaccins stimulent le système immunitaire pour qu’il reconnaisse et détruise les cellules tumorales. Par exemple, des vaccins à base d’ADN ou d’ARN ont été développés pour traiter des cancers comme celui du mélanome, en ciblant des antigènes spécifiques présents sur les cellules cancéreuses.
4. Diagnostic génétique : mieux comprendre les maladies
L’ingénierie génétique a permis d’améliorer les outils de diagnostic des maladies. Les tests génétiques permettent de détecter des mutations responsables de maladies héréditaires, d’analyser des biomarqueurs associés à des cancers ou encore de prédire la susceptibilité à certaines conditions médicales.
4.1. Tests génétiques pour les maladies héréditaires
Les tests génétiques sont utilisés pour diagnostiquer de nombreuses maladies génétiques, telles que la maladie de Huntington, la fibrose kystique, et la dystrophie musculaire. Ces tests permettent aux médecins de confirmer un diagnostic chez un patient présentant des symptômes, ou d’identifier des porteurs sains qui pourraient transmettre la maladie à leurs enfants. L’identification précoce des mutations génétiques permet également une gestion plus efficace de la maladie et des traitements adaptés.
4.2. Détection du cancer par analyse génétique
L’analyse des biomarqueurs génétiques est également devenue un outil essentiel dans le diagnostic et le suivi du cancer. Des tests comme ceux du gène BRCA1/BRCA2 permettent d’évaluer le risque de développer des cancers du sein et des ovaires. Les analyses génétiques peuvent également détecter des mutations spécifiques qui prédisposent à certains types de cancer, permettant une surveillance plus étroite et une prise en charge précoce.
5. Clonage thérapeutique : une approche controversée
Le clonage thérapeutique, qui consiste à créer des cellules souches embryonnaires génétiquement identiques à un individu, est une autre application controversée de l’ingénierie génétique. Cette technologie pourrait permettre de produire des tissus ou des organes pour traiter des maladies dégénératives telles que la maladie de Parkinson ou le diabète de type 1. Cependant, le clonage thérapeutique soulève des questions éthiques complexes concernant le statut des embryons et les risques potentiels liés à la manipulation des cellules souches.
6. Défis et enjeux éthiques
Malgré les avancées impressionnantes, l’ingénierie génétique dans le domaine médical fait face à plusieurs défis techniques et éthiques. Sur le plan technique, la précision des outils d’édition génétique, comme CRISPR, est encore perfectible. Bien que cette technologie offre des possibilités immenses, des erreurs dans le processus d’édition pourraient avoir des conséquences imprévues sur la santé des patients.
D’un point de vue éthique, l’ingénierie génétique soulève des questions concernant la modification de l’ADN humain, notamment en ce qui concerne les risques de mutations génétiques non intentionnelles, le clonage humain, et les inégalités d’accès aux traitements.
Conclusion
L’ingénierie génétique a profondément transformé le domaine médical, en offrant des solutions nouvelles et potentiellement révolutionnaires pour le traitement et la prévention des maladies. Que ce soit par la thérapie génique, la médecine personnalisée, les vaccins génétiques, ou le diagnostic avancé, cette technologie continue de redéfinir les frontières de la médecine moderne. Toutefois, son développement futur devra se faire dans un cadre éthique rigoureux afin de maximiser les bénéfices tout en minimisant les risques. Les prochaines décennies promettent des avancées encore plus spectaculaires, mais il est essentiel de concilier progrès scientifique et respect des valeurs humaines.